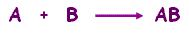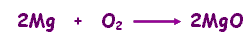بسم الله الرحمن الرحيم
السلام عليكم ورحمة الله وبركاته ..
اتحادCombination تفاعل يتم بين مادتين أو أكثر لتكوين مادة واحدة جديدة . يتم التعبير عن تفاعل الإتحاد بشكل عام كالآتي :
من الأمثلة على هذا النوع من التفاعلات تفاعل احتراق المغنيسيوم
اتزان كيميائي Chemical equilibrium
حالة تكون فيها سرعة التفاعل الأمامي مساوية لسرعة التفاعل العكسي ويعبر عادة عن التفاعل المتزن بأسهم متعاكسة .
من الأمثلة على الأنظمة المتزنة الاتزان الآتي :
احتراق Combustion
تفاعل المادة مع الأكسجين ، وينتج عنه طاقة .
عند حرق المادة يتكون أكسيد العنصر أو أكاسيد العناصر المحترقة .
فمثلاً :
عند حرق الكربون ( الفحم ) في جو شحيح الأكسجين يتكون أكسيد للكربون ( أول أكسيد الكربون ) :
عند حرق الكربون ( الفحم ) في جو غني بالأكسجين يتكون أكسيد للكربون ( ثاني أكسيد الكربون ) :
عند حرق المغنيسيوم يتكون أكسيد المغنيسيوم :
عند حرق الميثان يتكون أكسيد للكربون ( ثاني أكسيد الكربون ) ، وأكسيد للهيدروجين ( الماء ) :
احلال احادي Single displacement
تفاعل يتم فيه احلال عنصر نشط محل عنصر آخر أقل نشاطاً في أحد مركباته .
يتم التعبير عن تفاعل الإحلال الأحادي بشكل عام كالآتي :
من الأمثلة على هذا النوع من التفاعلات تفاعل محلول كبريتات النحاس مع فلز الخارصين :
حلال مزدوج Double displacement
تفاعل يتم بين مركبين ، بأن يحل الأيون الموجب من أحدهما محل الأيون الموجب في الآخر .
يتم التعبير عن تفاعل الإحلال المزدوج بشكل عام كالآتي :
من الأمثلة على هذا النوع من التفاعلات تفاعل محلول هيدروكسيد الصوديوم مع محلول حمض الهيدروكلوريك :