تقرير , بحث , عن الكيمياء التحليلية و طرائق التحليل/ الإمارات
تقرير , بحث , عن الكيمياء التحليلية و طرائق التحليل/ الإمارات
تقرير , بحث , للصف الثاني عشر الأدبي عن الكيمياء التحليلية و طرائق التحليل/ الإمارات
تقرير , بحث , للصف الثاني عشر الأدبي عن الكيمياء التحليلية و طرائق التحليل/ الإمارات
بسم الله الرحمن الرحيم
تقرير لمادة الكيمياء
عنوان التقرير:الكيمياء التحليلية و طرائق التحليل
عمل الطالب: ——————–
الصف: الثاني عشـــــ2ـــر الأدبي
___________________________________
المقدمة:
لقد كان لجابر بن حيان إنجازات كبيرة في مجال الكيمياء التحليلية ، حيث قام بتحضير الفولاذ وتنقية المعادن ، ثم بدأت الكيمياء التحليلية كفرع مستقل منذ عام 1907 م وتطورت منذ ذلك الحين فزادت قائمة الكواشف الكيميائية وطـرق التحليل للمواد اللاعضوية والعضوية وحدث توسع في استخدام طرق التحليل الفيزيائية والكيميائية الآلية والكيميائية الكهربية والكرومـاتوجرافية وطـرق التحليل الإشعـاعي وطرق التحليل الطيفي الكتلي :-
لذا اخترت الكتابة عن هذا الموضوع ، لأن الكيمياء التحليلية ضرورية في كل مطاف ، إذ يقوم الآلاف من المحللين الكيميائيين يوميًا بإجراء الملايين من التحاليل على عينات لمواد أولية ومنتجات وسطية ومخصبات معدنية والمياه والهواء وكذلك التحاليل الطبية ، وهي مقرر أساسي في أقسام الكيمياء حيث يتعرف الدارسون على طرق التحليل الحديثة وإجراء الأبحاث المعملية ، لإن دراسة الكيمياء التحليلية تنمي عند الطلاب الذهن الكيميائي وتغرس فيهم الخبرة في مجال التجربة الكيميائية ، كما تعودهم على الدقة والضبط في المعمل .
____________________________________
الموضوع:
إن علم الكيمياء التحليلة هو أحد فروع علم الكيمياء وبواسطته يتم الكشف عن العناصر والمواد ، كما يبين طرق فصل العناصر والمواد ومعرفة مكوناتها . سواء منفردة أو في خليط منها، إضافة إلى تقدير هذه المكونات تقديرًا كميًا.
وتشمل الكيمياء التحليلية على التحليل النوعي والتحليل الكمي، ويختص الأول بمعرفة نوع العناصر الموجودة في المركب، أما الثاني فيختص بإيجاد كل عنصر من العناصر.
أهمية الكيمياء التحليلية :
وتقوم الكيمياء التحليلية في كثير من العلوم بدور مهم ، وكذلك فهي لاغنى عنها أساسًا في علم الحياة ، إذ يستفاد من التقنية التحليلية في دراسة المواد الحية وعمليات التمثيل الغذائي وغيرها ، ولا يستطيع الأطباء تشخيص الامراض دون الاستناد إلى نتائج التحليلات اللازمة لذلك . كما نجد أن تقسيم المعادن جاء بعد معرفة تامة بالمكونات الكيميائية له . ولا يستطيع الفيزيائيون تشخيص نواتج تصادم الدقائق ذات الطاقة العالية بدون استخدام التقنية التحليلية في الصناعة الحديثة. إن قيمة المواد الخام ومدى نقاوة منتج صناعي وملاءمته للاستعمال والسيطرة على العمليات الصناعية في مرحلة أو أكثر نحتاج إلى معرفة الكيمياء التحليلية للتأكد من جودة الإنتاج الصناعي.
وتصنف الكيمياء التحليلية حسب الغرض من التحليل إلى :
أولاً : التحليل النوعي أو الوصفي :
هو مجموعة العمليات التي يتم فيها الكشف عن تركيب المواد أو المركبات أو العناصر الداخلة في تركيب مادة معينة أو خليط من المواد سواء أكان في الحالة الصلبة أو محلول في مذيب معين ولايتعرض هذا التحليل إطلاقًا إلى كميات هذه المكونات .
ثانيًا: التحليل الكمي :
ويبحث في تقدير كميات المكونات أو العناصر الداخلة في تركيب المركب الكيميائي أو الخليط ، ويتبين من هذا أن التحليل النوعي لمادة مجهولة التركيب يسبق عادة التحليل الكمي لها ؛ لأنه لا يجوز تقدير مادة معينة تقديرًا كميًا ما لم يتأكد من وجودها وصفيًا . ويشمل التحليل الكمي على :
التحليل الوزني :
ويتم التحليل الكمي بالوزن بترسيب المادة وتقديرها كميًا في هيئة عنصر منفرد أو مشتق معين معروف التركيب يفصل عن المحلول بالترسيب أو الطرد المركزي ثم غسله وتجفيفه ووزنه ، فيحسب وزن المادة المراد تقديرها من معرفتنا لوزن الراسب وتركيبه بدقة . فمثلا ً يمكن تعيين نسبة الكلور في ملح الطعام مثلا ً بإذابة وزن معين من الملح في الماء ثم إضافة محلول نترات الفضة إليه فيترسب على شكل كلوريد الفضة ، ثم يرشح الراسب ويغسل ويجفف ثم يوزن لمعرفة كمية الكلور ونسبته في الملح ، ويضم التحليل الوزني الطرق التي يتم فيها تقدير أوزان المواد أو بعض مكوناتها بطريقتين هما :-
أ- الطريقة المباشرة :
وفيها يتم تحديد قياسات الأوزان لنواتج العملية التحليلية المعروفة التركيب .
ب- الطريقة غير المباشرة :
إذ تحدد بواسطتها قياسات الأوزان المفقودة أو الناقصة في الوزن بوصفها نتيجة لخاصية التطاير بالعينة .
– طرق التحليل الحجمي :
تستعمل في هذه الحالة طرق مباشرة وغير مباشرة لتعيين أوزان المواد أو بعض مكوناتها وتشمل هذه الطرق ما يلي :-
أ- طريقة المعايرة :-
وتتضمن استعمال محاليل ذات تراكيز معلومة وقياس حجوم مثل هذه المحاليل التي تتفاعل كميًا مع محلول المادة المراد تقديرها لحد نقطة معينة تسمى نقطة التكافؤ أو نقطة انتهاء التفاعل التي يمكن الكشف عنها بواسطة الأدلة التي تتضمن تغيرًا حادًا في خواص المحلول كاللون أو التعكير الذي تلحظهما بالعين المجردة أو تقاس بالطرق الكيميائية الفيزيائية كقياس فرق الجهد أو التوصيل الكهربائي . ويسمى المحلول المعلوم التركيز بالمحلول القياسي وهو المحلول الذي يحتوي حجم معين منه على وزن معلوم من المادة المذابة . أما عملية إضافة المحلول القياسي من السحاحة إلى حجم معين من محلول المادة المجهولة التركيز في الدورق المخروطي أو العكس حتى يتم التفاعل فتسمى بعملية المعايرة. ومن قوانين التكافؤ الكيميائي وتحديد حجم المحلول القياسي المستعمل في المعايرة نستطيع أن نعين وزن المادة المجهولة أو النسب الوزنية لما فيها من مكونات سواء أكان بطرق مباشرة أو غير مباشرة .
– التحليل الغازي :
وتقاس بهذه الطريقة كمية الغازات المستهلكة وفيه تقدر المادة بتقدير حجم الغاز الذي قد يكون هو المادة المراد تقديرها أو ناتجًا عن تفاعل تلك المادة مع مواد أخرى بحيث تعطي غازًا يمكن تقديره . ويجب أن لا يفهم بأن عمليات التحليل الكمي والنوعي لا يمكن أن تتم إلا عن طريق التفاعلات الكيميائية . وعمليات الفصل بالطرق الطبيعية لها إثرها الواضح في بناء أكثر مراحل التحليل الكروماتوجرافي لمكونات الخليط ثم يلي ذلك التمييز بطرق كيميائية . ومع أن طرق التحليل الحجمي تتطلب توفر شروط وخبرة لتجاوز الأخطاء أو العيوب فأنها تفضل في التطبيق العملي والاستعمال على طرق التحليل الوزني ؛ على الرغم من دقة النتائج التي يمكن الحصول عليها عند استعمالها لكنها بطيئة وتستغرق وقتًا طويلا ً لإتمام التحليل ، قد يتجاوز الإنتظار للحصول على نتائجها عدة ساعات أو أيام ، وهو ما لا يتفق والحاجة العملية خاصة في السيطرة الكيميائية على العمليات الصناعية لتوجيه التفاعلات إلى الوجهة الصحيحة للحصول على نتائج ذات مواصفات عالية الجودة .
ثالثًا : طرق التحليل الآلي :
تقدر المادة بقياس بعض من خواصها الفيزيائية أو الكيميائية مثل الكثافة واللون ومعامل الإنكسار والتوصيلة الكهربائية والتغيرلت الحرارية والكهربائية …..الخ. وتعتمد هذه الطرق أساسًا على القياسات الآتية :
1-انبعاث الطاقة الضوئية :
يتضمن هذا القياس إثارة المادة إلى مستويات عالية من الطاقة بالطاقة الضوئية أو الكهربائية ثم رجوعها إلى مستوى طاقة منخفض فينبعث منها من الطاقة الممتصة وتكون مقياسًا لكمية المادة وذلك بواسطة الطرق الآتية :
أ- طرق تسجيل الطيف الإنبعاثي :
– حيث تثار المادة باستخدام القوس الكهربائي .
ب- المطياف الفوتومتري باللهب :
– حيث تثار المادة باستخدام أنواع مختلفة من اللهب وبعد رجوع المادة إلى حافة طاقة منخفضة تقاس كمية الضوء المنبعثة .
ج- وميض الأشعة السينية:
– حيث تثار المادة بأشعة سينية ذات طول موجي معين وبعد رجوعها إلى حالة طاقة منخفضة تقاس الأشعة المنبعثة وهي التي تقوم بتمييز العنصر .
2- امتصاص الطاقة الضوئية :
– ويتضمن قياس كمية الطاقة الضوئية عند طول موجه معينة تمتصها المادة المراد تحليلها ، ولهذا يمكن استخدام مايلي :
أ – الطرق الطيفية اللونية .
ب- الطرق الطيفية في المنطقة فوق البنفسجية .
ج- الطرق الطيفية في المنطقة تحت الحمراء .
د – طريقة الأشعة السينية .
هـ- الرنين النووي المغناطيسي : تتضمن هذه الطريقة التفاعل بين موجات الراديو وأنوية الذرات التي تكون في مجال مغناطيسي.
3-الطرق الكهربائية:
أ – التحليل بطريقة التوصيل الكهربائي :
– حيث يقاس التغير في معامل التوصيل الكهربائي لمحلول النموذج .
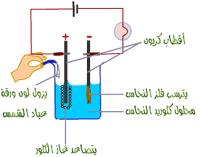
ب- التحليل بقياس فرق الجهد:
– حيث يقاس الجهد الكهربائي المتغير في أثناء التفاعل عند وضع القطب في المحلول ويمكن معرفة انتهاء التفاعل ومن ثم يمكن حساب تركيز المواد المتفاعلة .
ج- التحليل بقياس الكمية الكهربائية :
– تقاس الكمية الكهريائية بالكولوم اللازمة لإكمال التفاعل الكهروكيميائي.
د- البولاروجرافيا :
– تقاس قيمة التيار الكهريائي حيث تتناسب مع تركيز المادة التي تختزل أو تتأكسد في تفاعل كهروكيميائي عند القطب المايكروني .
4- التحليل الكروماتوجرافي :
– يعتمد هذا النوع من التحليل على اختلاف المواد بعضها عن بعض في ميلها للأمتزاز أو التجزئة أو التبادل خلال سطح مغلف بمذيب مناسب أو خلال مادة كيميائية ومن ثم يمكن أن تنفصل تلك المواد ، وتنقسم طرق التحليل الكروماتوجرافي إلى :
أ- كروماتوجرافيا الأدمصاص :
– ويقصد به التحليل الكروماتوجرافي عن طريق الأدمصاص على السطح.
ب- كروماتوجرافيا التبادل الأيوني :
– ويقصد به التحليل الكروماتوجرافي عن طريق تبادل الأيونات بين مادة التقدير وبين أيونات السطح الذي يحدث عملية التبادل وهي مادة كيميائية راتنجية .
ج- كروماتوجرافيا التجزئة :
– ويقصد به التحليل الكروماتوجرافي عن طريق الفصل التجزيئي لمخلوط من عدة مواد وتنقسم هذه الطريقة إلى كروماتوجرافيا العمود بالتجزئة ويتم فيها التحليل على عمود معبأ بمادة معينة .
د- كروماتوجرافيا الطبقة الرقيقة :
– وفيه يتم التحليل الكروماتوجرافي بالأدمصاص أو التوزيع على ألواح زجاجية تنثر عليها مادة مسامية يجرى عليها الفصل والتحليل .
هـ- كروماتوجرافيا الغاز :
– يتضمن هذا التحليل الكروماتوجرافي باستخدام غاز ناقل يقوم بحمل أبخرة المواد المحللة فيتم اتصال أبخرة هذه المواد تبعًا لدرجات غليانها أي تظهر أولا ً المواد ذات درجات الغليان المنخفضة يتبعها المواد ذات درجات الغليان العالية وتخرج هذه الأبخرة لتنضم إلى الغاز الناقل ومن ثم يمكن فصل هذه المواد عن بعضها وتعينها ويمكن أيضًا بطريقة كروماتوجرافيا الغاز إجراء التقدير الكمي لهذه المواد المنفصلة .
5- طرق مختلفة :
أ- التحليل باستخدام البولاروميتر :
– يقاس مقدار الانحراف الناتج عند مرور الضوء المستقطب خلال المحلول .
ب- التحليل بقياس انكسار الضوء :
– يقاس معامل الانكسار الذي يقوم بتعيين التركيب الكيميائي للخليط .
ج- مطياف الكتلة :
– يمكن بهذه الطريقة قياس النسبة بين شحنة كتلة أيونات مختلفة ناتجة من تكسير جزيئات كبيرة ومنه يمكن إيجاد الوزن الجزيئي والتركيز .
د- التوصيل الحرارة :
– وفيه يقاس التوصيل الحراري ويستدل منه على تركيب المادة .
هـ- طرق تحليل المواد المشعة :
– وفيه تشع المادة المادة لتصبح ذات نشاط إشعاعي ثم تعد الأشعة أو الجسيمات المتدفقة منها لغرض تقديرها كميًا .
________________________________
الخاتمة:
ومما سبق ، يمكن الآن تصنيف طرق التحليل إلى طرق كيميائية وطرق آلية .
تتضمن الطرق الكيميائية عمليات كيميائية تستخدم فيها أجهزة وزجاجيات بسيطة ، كما يكون الجزء الضروري فيها هو قياس حجم أو كتلة . في حين تتضمن الطرق الآلية استخدام آلات معقدة تعتمد على الكهرباء والبصريات والحرارة حيث تقاس الطاقة التي لها علاقة بتركيز النموذج.
_______________________________
المصادر والمراجع:
كتاب الكيمياء التحليلية .
د. صلاح أحمد محمد
Pr. A. j
Pr. B.d.
معهد الإمارات التعليمي http://www.uae.ii5ii.com
.~. صنع يدي .~.
تجدونهــا مع الترتيب في المرفقــــات